Thermique : Comment utiliser et contrôler les transferts thermiques ? Comprendre les avantages et les inconvénients de la combustion du carbone et des hydrocarbures
Hydrocarbures
Un hydrocarbure est une molécule composée uniquement d’atomes de carbone C et d’hydrogène H.
Par exemple, le méthane CH4, le propane C3H8, le butane C4H10, l’heptane C7H16, l’octane C8H18 sont des hydrocarbures.
Ben Mills and Jynto, Public domain, via Wikimedia Commons
Combustion des hydrocarbures
La réaction de combustion d’un hydrocarbure peut-être complète ou incomplète.
Réaction de combustion complète du méthane CH4
Compléter les coefficients permettant d’équilibrer l’équation chimique (conservation du nombre d’atomes) :
CH4 + … O2 -> CO2 + …. H2O
(méthane – combustible + dioxygène en excès – comburant -> dioxyde de carbone + eau)
Réaction de combustion incomplète du méthane CH4
CH4 + O2 -> C + 2H2O
(méthane + dioxygène en défaut -> carbone + eau)
Le dégagement de carbone va noircir l’équipement.
Un gaz toxique inodore et incolore peut être dégagé : le monoxyde de carbone (CO).


Une réaction de combustion convertit une énergie chimique en énergie thermique (chaleur).
Un moteur thermique a pour objectif de convertir l’énergie libérée par la combustion en énergie mécanique.
Environnement et effet de serre
« Utilisés massivement, comme source d’énergie notamment, depuis quelques décennies, les hydrocarbures constituent une source de gaz à effet de serre majeure et un danger pour l’environnement. La menace du réchauffement climatique conduit donc à chercher à en limiter la consommation. D’autant que la ressource n’est pas renouvelable, à l’échelle humaine. Elle résulte de la décomposition de matière organique accumulée dans des bassins sédimentaires pendant des millions d’années. Les gisements d’hydrocarbures conventionnels commencent à s’épuiser et l’exploitation d’hydrocarbures non conventionnels a été lancée pour continuer de subvenir aux besoins. »
https://www.futura-sciences.com/
Distinguer les trois modes de transferts thermiques
Le transfert d’énergie thermique se fait spontanément du corps le plus chaud vers le corps le plus froid.
Il existe trois modes de transfert d’énergie thermique :
| La conduction | La convection | Le rayonnement |
| Transfert d’énergie par contact. | Transfert d’énergie par déplacement de matière dans le milieu. | Transfert d’énergie sans contact, par rayonnement électromagnétique (ex : soleil) Peut se faire dans le vide. |
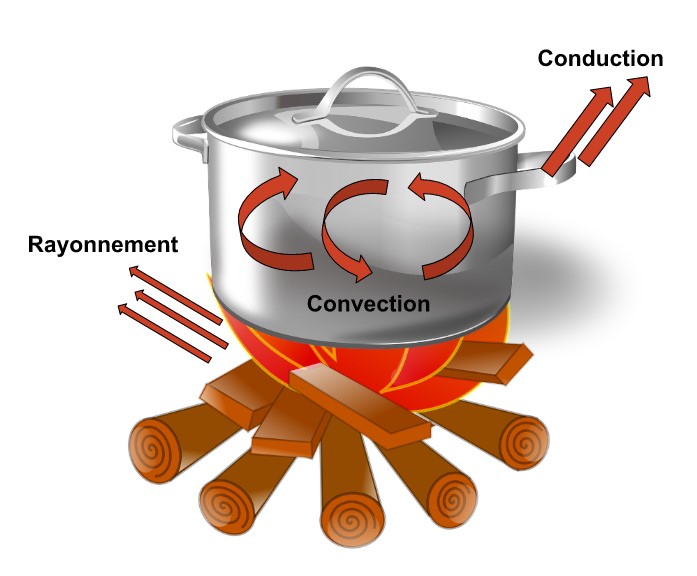
Il existe des matériaux bons conducteurs thermiques qui transfèrent facilement la chaleur, comme les métaux et des matériaux isolants thermiques (bois, polystyrène…) qui résistent au passage de la chaleur.
Energie libérée par la combustion d’une masse donnée d’hydrocarbure
Pour déterminer l’énergie libérée (en Joules) par une masse donnée d’hydrocarbure il faut tout d’abord déterminer sa quantité de matière n (nombre de moles) :
A partir d’une masse
n : quantité de matière (en moles)
m : masse en g
M : masse molaire en g/mol
n = m / M
A partir d’un volume
n : quantité de matière (en moles)
V : volume en L
Le volume d’une mole de gaz est de 22,4 L / mol dans les conditions normales de température et de pression
n = V / 22,4
L’énergie libérée Elibérée peut alors être déterminée à partir de la valeur de l’énergie de combustion Ecombustion par :
Elibérée : énergie libérée en J
n : quantité de matière (en moles)
Ecombustion en J/mol
Elibérée = n x Ecombustion
Exercices combustion des hydrocabures
Exercice 1 : combustion du butane dans une gazinière.
La gazinière de mamie est alimentée au sous-sol par une bouteille de gaz contenant 13 kg de butane.
1.) Calculer la masse molaire moléculaire du butane de formule brute C4H10.
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..

2.) Calculer, en mol, la quantité de matière de butane contenue dans la bouteille de 13 kg. Arrondir le résultat à l’unité.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
3.) Compléter l’équation de la combustion complète du butane dans le dioxygène.
2 C4H10+ 13 O2 -> …… CO2+ …… H2O
4.) En utilisant l’équation précédente, déterminer le nombre de moles de dioxygène nécessaires à la combustion de 224 moles de butane.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
5.) En déduire le volume de dioxygène consommé lors de cette combustion complète.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Données :
masses molaires: M(C) = 12 g/mol M (H) = 1 g/mol
Volume molaire du dioxygène dans les conditions d’utilisation de la gazinière : Vm= 24 L/mol
Exercice 2 : combustion d’octane, essence de voiture.
L’octane est le principal constituant de l’essence. On se propose de calculer la masse de CO2 rejeté dans l’air par la combustion complète d’un plein de carburant qui contient 36 kg d’octane.
Calculer la masse molaire de l’octane C8H18.
On donne : M(C) = 12g/mol M(H) = 1g/mol M(O) = 16 g/mol.
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
2.) L’équation chimique de la combustion de l’octane est donnée ci-dessous. Équilibrer cette équation.
2C8H18+ ….. O2 -> …… H2O + …. CO2
3.) Le réservoir d’une automobile contient 36 kg d’octane. Calculer, en mole, la quantité de matière d’octane contenue dans ce réservoir. Arrondir le résultat à l’unité.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
4.) En déduire le nombre de moles de CO2 produites par la combustion complète de 36 kg d’octane.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
5.) Calculer alors, en kg, la masse de CO2 rejeté dans l’air. Arrondir le résultat à l’unité.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Donnée: M(CO2) = 44 g/mol
6.) L’octane a une masse volumique ρoctane = 703 kg/m3. Calculer, en l arrondie à l’unité, la quantité d’essence représentée par 36 kg d’octane :
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Compétences, capacités et connaissances issues du référentiel BAC PRO Premières – Physique Chimie Education Nationale
Capacités
Réaliser expérimentalement une réaction de combustion de charbon ou d’un hydrocarbure et identifier les produits de la combustion.
Calculer l’énergie libérée sous forme d’énergie thermique par la combustion d’une masse donnée d’hydrocarbure à partir de données fournies.
Écrire et ajuster l’équation de la réaction modélisant la combustion d’un hydrocarbure.
Déterminer la masse de dioxyde de carbone (CO2) dégagée par la combustion complète d’une masse donnée d’un hydrocarbure à partir de données fournies.
Mettre en évidence expérimentalement les trois modes de transfert thermique. Décrire qualitativement les trois modes de transfert thermique en citant des exemples.
Comparer expérimentalement de façon qualitative les propriétés de plusieurs matériaux vis-à-vis de la conduction thermique.
Connaissances
Connaître les produits de la combustion complète ou incomplète d’un hydrocarbure dans l’air.
Connaître la dangerosité des composés produits lors d’une combustion incomplète.
Savoir que la combustion d’un hydrocarbure ou du charbon libère de l’énergie thermique.
Savoir que l’énergie utilisée aujourd’hui est très majoritairement obtenue à l’aide de combustions de ce type.
Savoir que le dioxyde de carbone est un des principaux gaz à effet de serre et que l’augmentation de sa concentration dans l’atmosphère accentue le réchauffement climatique.
Savoir que les moteurs thermiques convertissent l’énergie libérée par la combustion en énergie mécanique.
Savoir qu’un transfert thermique se fait spontanément du corps le plus chaud vers le corps le plus froid.
Connaître les trois modes de transfert thermique et leurs caractéristiques principales.
Connaître des exemples de matériaux bons conducteurs thermiques et de matériaux isolants thermiques.

