Chimie : Comment analyser, transformer ou exploiter les matériaux dans le respect de l’environnement ? Prévoir une réaction d’oxydoréduction et protéger les métaux contre la corrosion.
Oxydoréduction
Une réaction d’oxydoréduction consiste en un transfert d’électrons :
– une réaction d’oxydation, un élément chimique perd des électrons.
– une réaction de réduction, un élément chimique gagne des électrons.
L’élément réducteur perd des électrons et réduit l’oxydant (lui fait gagner des électrons).
L’élément oxydant gagne des électrons et oxyde le réducteur (lui fait perdre des électrons).
Exemple de réaction d’oxydoréduction
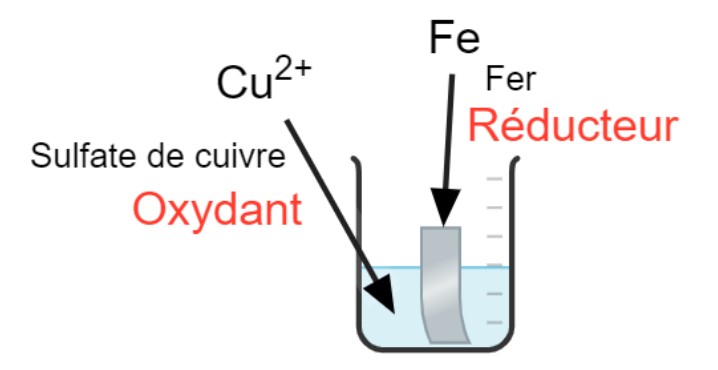
Oxydation du Fer (métallique) :
Fe → Fe2+ + 2 e–
Réduction du cuivre :
Cu 2+ + 2 e– → Cu
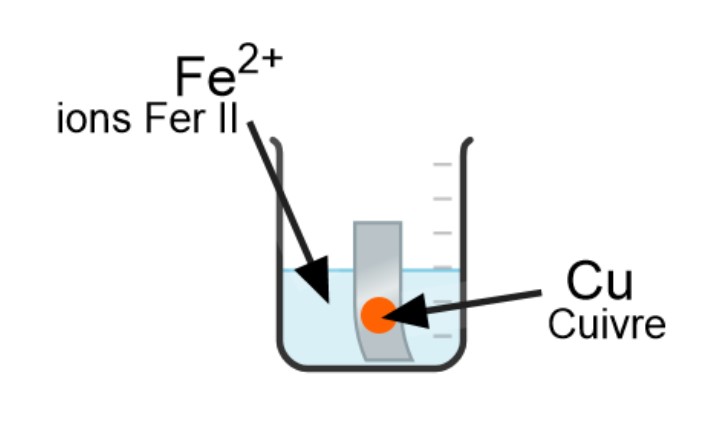
Réaction d’oxydoréduction complète :
Fe + Cu 2+ → Fe2+ + Cu
Classification électrochimique des couples oxydant/réducteur
Cette classification permet de prévoir une réaction spontanée d’oxydoréduction : l’oxydant le plus fort réagit avec le réducteur le plus fort. La réaction suit le sens du gamma 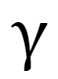
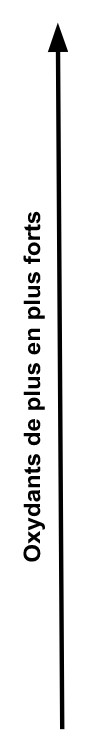 | Au3+ / Au Cl2 / Cl– MnO2 / Mn2+ Hg2+ / Hg Ag+ / Ag Fe3+ / Fe2+ I / I– Cu2+ / Cu H+ / H Pb2+ / Pb Sn2+ / Sn Ni2+ / Ni Fe2+ / Fe Cr3+ / Cr Zn2+ / Zn Al3+ / Al Mg2+ / Mg Na+ / Na Ca2+ / Ca K+ / K |  | 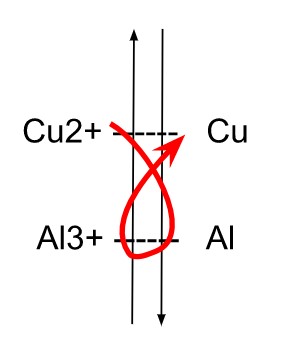 |
Protection des métaux contre la corrosion
La corrosion c’est l’altération d’un métal suite à la réaction chimique avec un oxydant : dioxygène O2 , cations H+,, les ions chlorure (NaCl dans l’eau de mer par exemple)…
Il est possible de protéger les métaux contre la corrosion :
– en les recouvrant d’une couche protectrice de vernis, peinture, laque, revêtement plastique…ou d’une couche métallique (galvanisation (couche de zinc), nickelage, argenture, cadmiage…)
– par la protection cathodique à courant imposé (exemple des canalisations).
– grâce à une anode sacrificielle (exemple des coques de bateau en acier (Fer + carbone) avec une anode en zinc. Le zinc plus réducteur que le fer sera oxydé en premier.
Certains métaux comme l’aluminium ou l’acier inoxydable (plus de 10,5 % de chrome) se protègent spontanément par passivation. Ils produisent une couche d’oxyde métallique qui forment une couche de protection.
Exercices oxydoréduction
Exercice 1 : pare-chocs chromé.
Le pare-choc des véhicules anciens étaient réalisés à base d’éléments en fer et recouverts d’une couche de chrome : ils étaient chromés.
1.) Déterminer à l’aide de la classification électrochimique des couples oxydant/réducteur les couples en présence dans cette situation :
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………

2.) Ecrire les deux demi-équations chimiques faisant intervenir ces couples :
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
3.) En déduire et équilibrer l’équation de la réaction d’oxydoréduction faisant intervenir ces deux couples :
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
4.) Expliquer pourquoi le fer est protégé contre la corrosion par le chrome ?
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
5.) Dans cette situation l’ajout d’un revêtement métallique permet de lutter contre la corrosion. Donner deux autres méthodes de protection des métaux contre la corrosion :
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Exercice 2 : anode sacrificielle.
Une hélice de bateau est en acier composé à 98 % de fer et 2% de carbone. Une anode de zinc est fixée sur le carter.
1.) En vous aidant de la classification électrochimique ci-dessous, déterminer les couples oxydant/réducteur pouvant réagir :
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………


2.) Parmi les métaux en présence, quel est le plus réducteur ?
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
3.) Ecrire la demi-équation d’oxydation de l’élément le plus réducteur :
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
4.) Expliquer en une phrase le rôle de l’anode de zinc :
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
Compétences, capacités et connaissances issues du référentiel Terminale BAC PRO – Physique Chimie Education Nationale
Capacités
Classer expérimentalement des couples oxydant/réducteur.
Écrire l’équation de réaction modélisant une transformation d’oxydoréduction à partir de deux demi-équations de réaction.
Identifier l’oxydant et le réducteur dans une transformation d’oxydoréduction d’équation de réaction donnée.
Prévoir à partir d’une classification électrochimique qualitative, le sens d’évolution spontané d’une transformation d’oxydoréduction.
Connaissances
Savoir qu’une réduction est un gain d’électrons et qu’une oxydation est une perte d’électrons.
Savoir qu’une transformation d’oxydoréduction est une réaction dans laquelle intervient un transfert d’électrons.
Savoir qu’il est possible d’établir une classification électrochimique des couples oxydant/réducteur et connaître son intérêt (prévision de réaction redox entre un oxydant et un réducteur donné, écriture de l’équation de réaction modélisant la transformation d’oxydoréduction).
Savoir qu’une réaction d’oxydoréduction spontanée se produit entre l’oxydant le plus fort et le réducteur le plus fort.


Il y a-t-il des corrections mis en lignes?
Bonjour,
Vous ne trouverez ici que les corrections d’examens.
Mais si vous avez une question sur un exercice vous pouvez la poser en commentaire 🙂