Thermique : Comment utiliser et contrôler les transferts thermiques ? Comprendre les avantages et les inconvénients de la combustion du carbone et des hydrocarbures
Objectifs 
- Réaliser expérimentalement une réaction de combustion de charbon ou d’un hydrocarbure et identifier les produits de la combustion.
- Calculer l’énergie libérée sous forme d’énergie thermique par la combustion d’une masse donnée d’hydrocarbure à partir de données fournies.
- Écrire et ajuster l’équation de la réaction modélisant la combustion d’un hydrocarbure.
- Déterminer la masse de dioxyde de carbone (CO2) dégagée par la combustion complète d’une masse donnée d’un hydrocarbure à partir de données fournies.
Matériel 
- une bougie chauffe-plat
- un bocal à combustion
- un tube à essai avec bouchon
- une pissette d’eau de chaux
- une pince en bois
Dans la suite du document, ce symbole signifie « Appeler le professeur ».
Pensez à préciser les unités des valeurs relevées ou calculées.
★ = 1 pt ☆ = 0,5 pt
Combustion de la paraffine
………. / 10 pts
Une bougie chauffe-plat est composée d’un hydrocarbure : la paraffine.

Définition d’un hydrocarbure ( source : https://fr.wikipedia.org/wiki/Hydrocarbure )
1.) Déterminer la formule brute de la paraffine si n = 25 et m = 2n+2 :
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………
☆☆ C1 C2
2.) Compléter :
La molécule de paraffine est composée de ….. atomes de ………………….. et ….. atomes de ……………………
☆☆☆☆ C1 C5
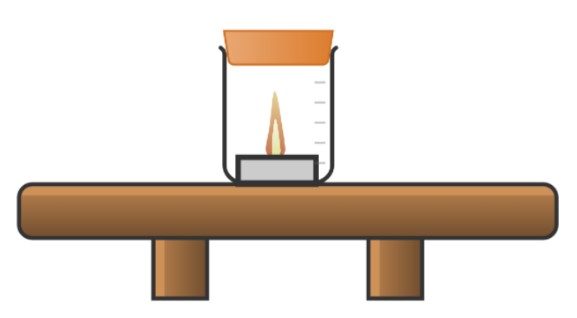
3.) Expérience 1 :
Allumer la bougie chauffe-plat, la placer dans le bocal à combustion et fermer le bouchon.
Reproduire l’expérience plusieurs fois.
Qu’observez-vous au niveau de la bougie ?
a.) ………………………………………………………………☆ C2 C3
b.) ………………………………………………………………☆ C2 C3
c.) Interprétation :
La combustion nécessite un combustible : ……………………..de formule chimique ………… ☆☆ C4
La combustion nécessite un comburant : ………………………….. de formule chimique ………… ☆☆ C4
d.) Ces deux éléments sont les :
◻ produits de la réaction chimique
◻ réactifs de la réaction chimique
☆☆ C2
4.) Expérience 2 :
- Allumer la bougie chauffe-plat et maintenir un tube à essai au-dessus de la flamme pendant une minute (utiliser la pince en bois).
a.) Qu’observez-vous ? Préciser le nom et la formule chimique du produit de la combustion identifié.
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
☆☆ C2 C3
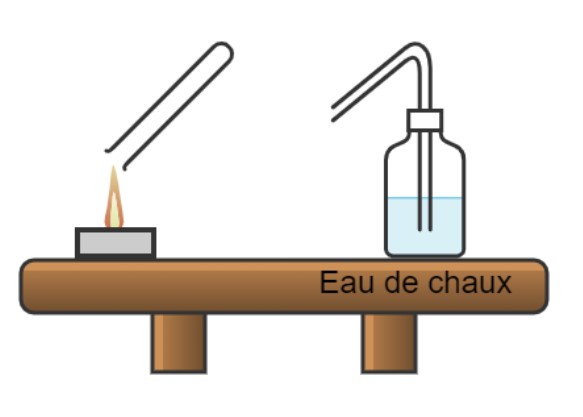
Renouveler l’expérience, verser un peu d’eau de chaux dans le tube, boucher et agiter énergiquement. Observer.

Eau de chaux ( Source : https://fr.wikipedia.org/wiki/Eau_de_chaux)
b.) Après avoir lu l’encart ci-dessus, que pouvez-vous conclure sur le gaz produit par la combustion de la bougie (préciser sa formule chimique) ?
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
☆☆ C2 C3
c.) Les produits de la combustion complète de la paraffine sont :
◻ CH4 et CO2
◻ H20 et CO
◻ CO2 et H2O
◻ C7H16 et O2
☆☆ C4
Energie libérée par la combustion de la paraffine
………. / 5 pts
5.) Equation bilan de la réaction de combustion :
Compléter et équilibrer l’équation de la réaction de combustion de la paraffine :
C….H…. + ………. O2 → ………. H2O + ………. CO2

Appeler le professeur et présenter votre équation-bilan équilibrée
☆ C1 ☆ C2 ☆ C3 ☆ C5
6.) Energie libérée par la combustion :
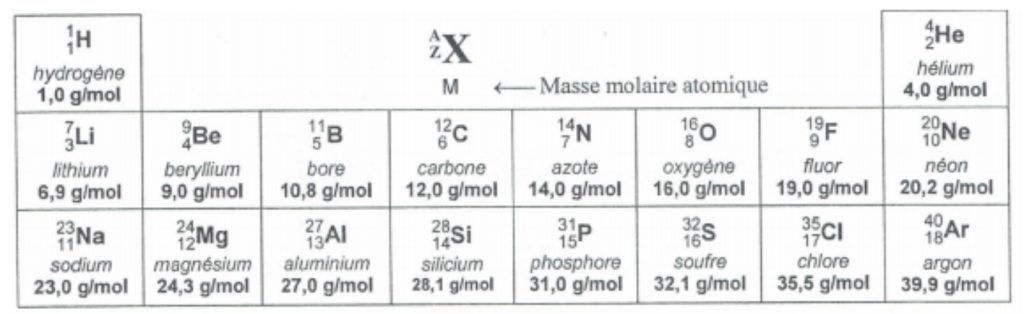
a.) A l’aide de la classification périodique réduite ci-dessus, calculer, en g/mol, la masse molaire de la paraffine :
M (C25H52) = ……………………………………………………………………….
☆☆ C1 C3

La quantité de matière est notée n. Elle désigne un nombre d’atomes, de molécules, d’ions…Son unité est la mole (mol).
Rappel : une mole représente environ 6.02 x 1023 entités (constante d’Avogadro).
n = m / M
n : quantité de matière (en mol)
m : masse (en g)
M : masse molaire (en g/mol)
b.) Calculer le nombre de moles de paraffine pour 10 g de bougie, arrondir à 10-3 :
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
☆☆ C1 C3
c.) La paraffine présente une énergie de combustion de 15,3.103 kJ/mol. Calculer l’énergie libérée par la combustion de 10 g de bougie :
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
☆☆ C3
Application : masse de dioxyde de carbone produite par un véhicule.
………. / 5 pts
Le dioxyde de carbone CO2 est un des principaux gaz à effet de serre. L’augmentation de sa concentration dans l’atmosphère accentue le réchauffement climatique.
On considère que l’essence est constituée d’octane (C8H18) et une voiture qui consomme 5,8 l / 100 km.
On cherche à connaître la masse de CO2 produite par cette voiture au km.

a.) Ecrire et équilibrer la réaction de combustion de l’octane :
……C8H18 + ………. O2 → ………. H2O + ………. CO2
☆☆ C1 C3
b.) Calculer la masse molaire du CO2 :
M (CO2) = ………………………………………………………………………………………… ☆ C1 C3
c.) Calculer la masse molaire de l’octane C8H18 :
M (C8H18) = ………………………………………………………………………………………… ☆ C1 C3
d.) La masse volumique de l’essence est ρessence = 0,74 kg/l. Calculer la masse d’essence (octane) brûlée au km :
mC8H18 = ………………………………………………………………………………………… ☆ C1 C3
e.) Calculer le nombre de moles d’octane brûlé au km ( Rappel : n = m / M ) :
nC8H18 = ………………………………………………………………………………………… ☆ C1 C3
f.) A l’aide de l’équation- bilan de la réaction de combustion, en déduire le nombre de moles de dioxyde de carbone produit au km :
nCO2 = ………………………………………………………………………………………… ☆ C2 C3
g.) Calculer, en g, la masse de CO2 produite au km par cette voiture :
mCO2 = ………………………………………………………………………………………… ☆ C3
h.) Chercher sur internet des valeurs moyennes de CO2 produite au km et commenter votre résultat :
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
☆☆ C4 C5
Compétences, capacités et connaissances issues du référentiel BAC PRO Premières – Physique Chimie Education Nationale
Capacités
Réaliser expérimentalement une réaction de combustion de charbon ou d’un hydrocarbure et identifier les produits de la combustion.
Calculer l’énergie libérée sous forme d’énergie thermique par la combustion d’une masse donnée d’hydrocarbure à partir de données fournies.
Écrire et ajuster l’équation de la réaction modélisant la combustion d’un hydrocarbure.
Déterminer la masse de dioxyde de carbone (CO2) dégagée par la combustion complète d’une masse donnée d’un hydrocarbure à partir de données fournies.
Connaissances
Connaître les produits de la combustion complète ou incomplète d’un hydrocarbure dans l’air.
Connaître la dangerosité des composés produits lors d’une combustion incomplète.
Savoir que la combustion d’un hydrocarbure ou du charbon libère de l’énergie thermique. Savoir que l’énergie utilisée aujourd’hui est très majoritairement obtenue à l’aide de combustions de ce type.
Savoir que le dioxyde de carbone est un des principaux gaz à effet de serre et que l’augmentation de sa concentration dans l’atmosphère accentue le réchauffement climatique. Savoir que les moteurs thermiques convertissent l’énergie libérée par la combustion en énergie mécanique.
Compétence – C1
S’approprier
Rechercher, extraire et organiser l’information.
Traduire des informations, des codages.
Compétence – C2
Analyser
Raisonner
Émettre des conjectures, formuler des hypothèses.
Proposer, choisir une méthode de résolution ou un protocole expérimental.
Élaborer un algorithme.
Compétence – C3
Réaliser
Mettre en œuvre une méthode de résolution, des algorithmes ou un protocole expérimental en respectant les règles de sécurité.
Utiliser un modèle, représenter, calculer.
Expérimenter, faire une simulation.
Compétence – C4
Valider
Exploiter et interpréter des résultats ou des observations de façon critique et argumentée.
Contrôler la vraisemblance d’une conjecture, de la valeur d’une mesure.
Valider un modèle ou une hypothèse.
Mener un raisonnement logique et établir une conclusion.
Compétence – C5
Communiquer
Rendre compte d’un résultat, à l’oral ou à l’écrit en utilisant des outils et un langage approprié.
Expliquer une démarche.


Bonjour, comment pouvons nous avoir accès à la correction ?
Bonjour Juliette,
Je ne diffuse pas de correction mais si vous voulez la correction d’une question on peut voir ça dans ces commentaires.
Bonne rentrée !
Bonjour il existe en PDF le document svp ou en word ?
Non désolé, les cours et T.P ne sont pas dispos en format word ou pdf.