Chimie : comment caractériser une solution ?
Atomes
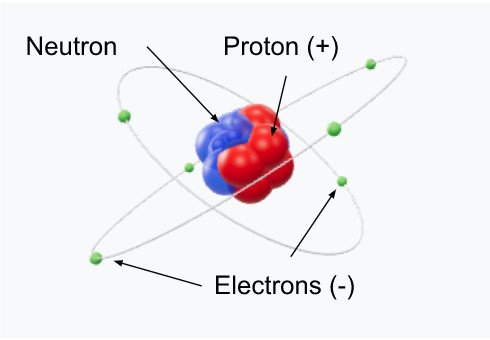
Un atome est composé d’un noyau (protons (+) et neutrons) autour duquel gravitent les électrons (-).
L’atome est électriquement neutre : il comporte autant d’électrons que de protons.
La classification périodique des éléments recense les atomes en précisant leurs noms et leurs symboles.
Le tableau périodique proposé par google permet de visualiser la structure des atomes, le mouvement des électrons sur leurs couches autour du noyau et de les projeter en réalité augmentée à partir d’un smartphone.
| Nom de l’atome | Symbole | Modèle atomique |
| Carbone |  | |
| Hydrogène | 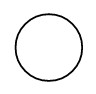 | |
| Oxygène |  |
Molécules
Une molécule est un assemblage d’atomes. Sa formule indique le nombre d’atomes de chaque élément la composant.
| Nom de la molécule | Formule chimique | Composition | Modèle moléculaire |
| Dioxygène | 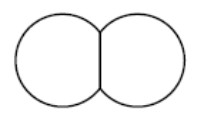 | ||
| Dioxyde de carbone | 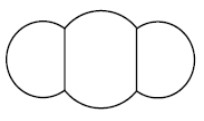 | ||
| Eau | 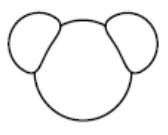 | ||
| Méthane | 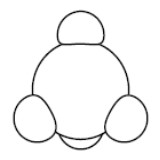 |
Identification des ions
Un ion est un atome qui a perdu ou gagné des électrons (les particules qui gravitent autour du noyau de l’atome).
L’ion Cu2+ est un atome de cuivre qui a perdu 2 électrons, il a donc deux charges positives (protons) « en trop » dans son noyau, c’est un cation.
L’ion chlorure Cl– est un atome de chlore qui a gagné 1 électron, il a donc une charge négative (électron) « en trop », c’est un anion.
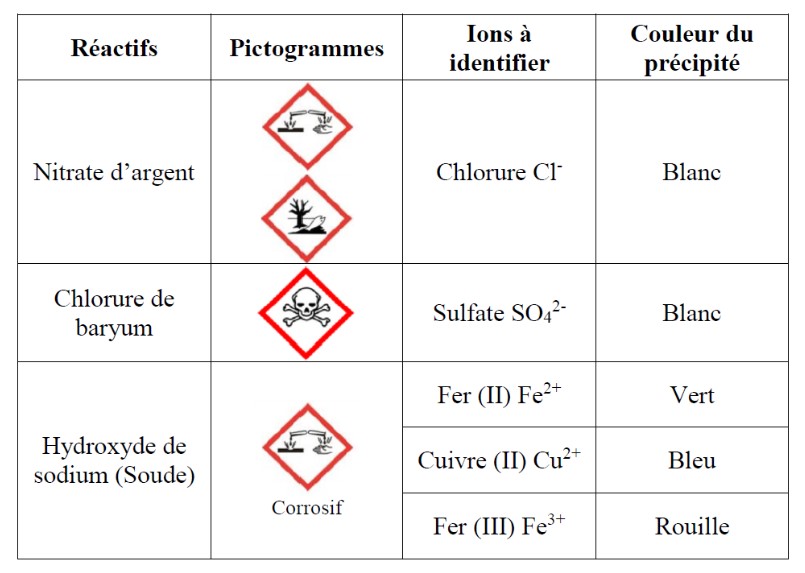
Il est possible d’identifier un ion dans une solution grâce à un réactif approprié (voir tableau). Le test est positif (l’ion est présent dans la solution) quand un précipité (insoluble) apparaît.
| Ion | Réactif | Couleur du précipité |
| Chlorure – Cl– | Nitrate d’argent – AgNO3 | Blanc |
| Sulfate – SO42- | Chlorure de baryum – BaCl2 | Blanc |
| Calcium – Ca2+ | Oxalate d’ammonium – (NH₄)₂C₂O₄ | Blanc |
| Cuivre – Cu2+ | Hydroxyde de sodium (Soude) – NaOH | Bleu |
| Zinc – Zn2+ | Hydroxyde de sodium (Soude) – NaOH | Blanc |
| Fer II – Fe2+ | Hydroxyde de sodium (Soude) – NaOH | Vert |
| Fer III – Fe3+ | Hydroxyde de sodium (Soude) – NaOH | Rouille |
Sécurité
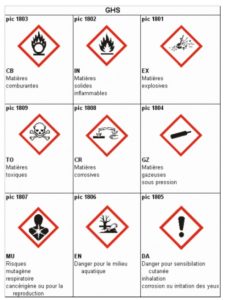
Après avoir lu le tableau des pictogrammes de danger, préciser les équipements de sécurité qui manquent à ce professeur de sciences.

Liste des équipements de sécurité
………………………………………………………………………………………………………………………………………..
………………………………………………………………………………………………………………………………………..
………………………………………………………………………………………………………………………………………..
Exercices de chimie en CAP :
Exercice 1 : du métal dans l’eau de la piscine ?
Luc a rempli sa piscine de jardin avec l’eau d’un puits. Un vendeur lui a alors précisé qu’il fallait tester la présence éventuelle de métaux dissous sous forme d’ions dans l’eau pour éviter de tâcher la piscine.
Si l’eau contient des métaux, il faudra alors utiliser un produit appelé un séquestrant à métaux.
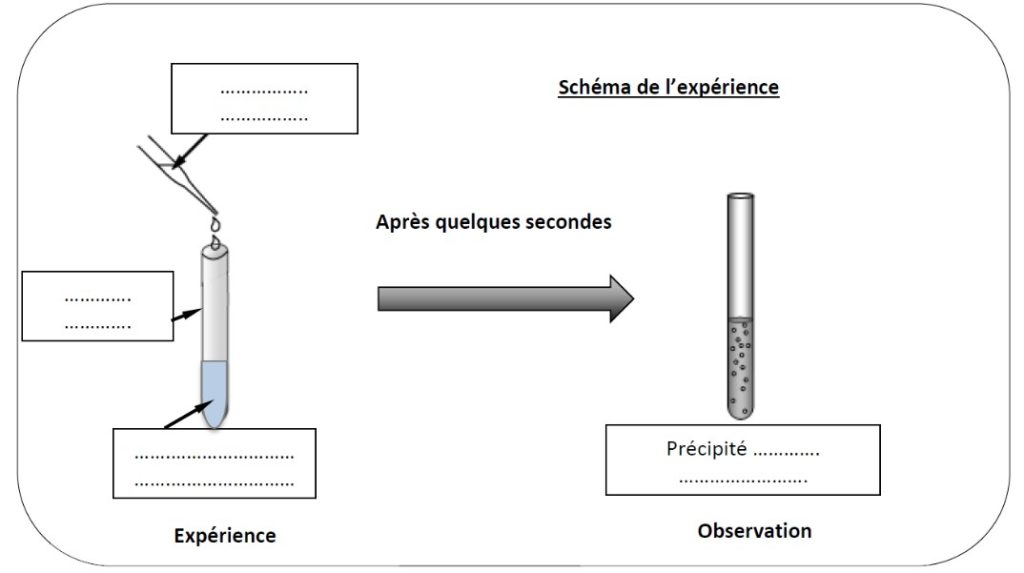
Luc décide de tester son eau et procède à une expérience :
Il prélève de l’eau de sa piscine dans un tube à essai.
Il verse à l’aide d’un compte-gouttes, dans le tube à essai, 3 gouttes d’un réactif.
Il observe un précipité de couleur bleue dans le tube.

1.) Compléter la légende avec les informations données ci-dessus :
2.) À l’aide du tableau 2 présenté ci-dessus, indiquer le réactif que doit utiliser Luc pour détecter la présence de métaux (fer ou cuivre) dans l’eau.
3.) Indiquer les précautions à prendre pour manipuler en sécurité ce réactif.
4.) Indiquer le nom de l’ion que Luc a identifié dans l’eau de sa piscine.
5.) Rayer les mentions inutiles.
Cet ion est issu d’un atome de fer / cuivre qui a gagné / perdu1 / 2 / 3 électrons
6.) Indiquer la condition qui nécessite l’utilisation d’un séquestrant à métal.
7.) Luc doit-il ajouter un séquestrant à métal dans l’eau de sa piscine ? Justifier la réponse.
Exercice 2 : fabriquer du gel hydroalcoolique.
Paul souhaite fabriquer du gel hydro alcoolique. Il a trouvé sur internet cette composition :
Glycérol (C3H8O3) ;
Eau oxygénée (peroxyde d’hydrogène H2O2) à 3% ;
Éthanol (C2H5OH).
Concentré, le peroxyde d’hydrogène est dangereux car corrosif et inflammable.
Voici l’étiquette que l’on trouve sur la bouteille :

1.) Entourer sur l’étiquette ci-dessus le pictogramme indiquant que le peroxyde d’hydrogène est corrosif.
2.) Parmi les choix ci-dessous, cocher les trois protections à utiliser pour manipuler le peroxyde d’hydrogène concentré.
◻ lunettes de protection
◻ protections auditives
◻ blouse
◻ casque
◻ chaussures de sécurité
◻ gants
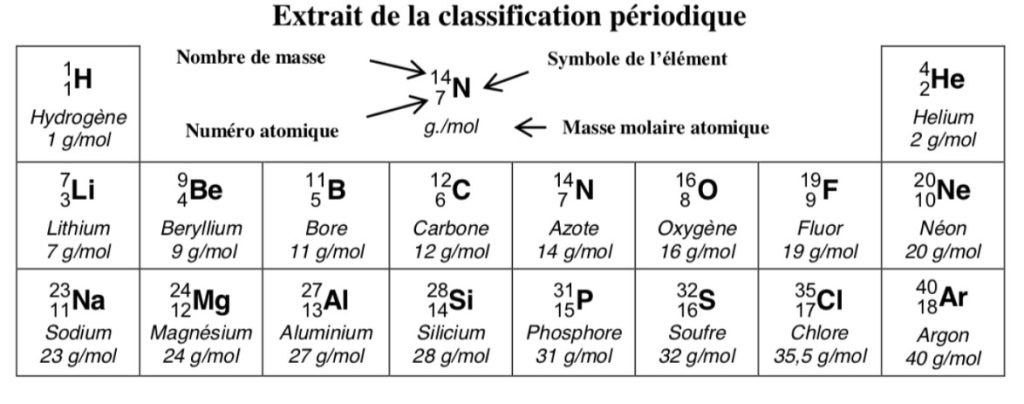
3.) Le tableau ci-dessous détaille les éléments chimiques présents dans la molécule de glycérol (C3H8O3). Compléter ce tableau en vous aidant de l’extrait de la classification périodique des éléments ci-dessous.
| Symbole de l’élément | ……………………………………………………….. | ……………………………………………………….. | ……………………………………………………….. |
| Nom de l’élément | ……………………………………………………….. | ……………………………………………………….. | ……………………………………………………….. |
| Nombre d’atomes présents dans la molécule de glycérol | ……………………………………………………….. | ……………………………………………………….. | ……………………………………………………….. |
Exercice 3 : nettoyage à l’eau de javel.
Mme Léonard nettoie son local en utilisant de l’eau de Javel contenue dans le bidon ci-dessous :
1.) Donner le nombre de pictogrammes de sécurité figurant sur l’étiquette :
……………………………………………………………………………………………………………….………………………………………………………………………………

2.) Indiquer deux précautions à prendre pour manipuler de l’eau de Javel. On pourra s’aider du tableau fourni ci-dessous :
L’eau de Javel (NaClO) contient des éléments chlore et sodium. À l’aide de l’extrait de la classification périodique des éléments ci-dessus, indiquer les symboles de ces éléments chimiques :
Chlore : ………………………
Sodium : …………………….
.
Compétences, capacités et connaissances issues du programme CAP Physique Chimie Education Nationale
Capacités
Identifier expérimentalement des espèces chimiques en solution aqueuse.
Associer les éléments à leur symbole à l’aide de la classification périodique.
Interpréter une formule chimique en termes atomiques.
Construire un modèle moléculaire à partir d’une formule chimique simple.
Connaissances
Connaître la différence entre ion, molécule et atome.

